Активна реакція. рН більшості природних вод коливається від 6,5 до 9,2. Найкислішими з природних вод є болотисті, що містять гумінові речовини, основними — підземні води, багаті на бікарбонати; рН води відкритих водойм поза нормами свідчить про забруднення стічними водами. Рекомендується рН 7—8,5/МПР 6,5-9,2 (МСПВ-73).
Щільний залишок характеризує ступінь загальної мінералізації води. Його визначають шляхом випарювання профільтрованої води і висушування залишку за температури 110 °С до постійної маси. Результат вираховують у міліграмах віл води. На основі викладеного рекомендують, щоб щільний залишок води не перевищував 500 мг/л. У районах, де немає такої води, за погодженням із органами охорони здоров'я може бути дозволено використання у водогонах навіть води, яка містить понад 1000 мг солей в 1 л. У багатьох спекотних країнах доводиться використовувати для питного постачання воду, що містить до 2000—3000 мг/л солей, якщо вона не має дуже неприємного присмаку і не спричинює проносу. Місцева дія залежить від складу солей і рівня водоспоживання.
Загальна твердість води переважно зумовлюється наявністю в ній кальцію і магнію, які містяться у вигляді карбонатів, біокарбонатів, хлоридів і сульфатів.
Твердість води вимірюють у міліграм-еквівалентах на 1 л: 1 мг-екв/л твердості відповідає вмісту 28 мг/л СаО або 20,16 мг/л MgO. Воду до 3,5 мг-екв/л називають м'якою, від 3,5 до 7 мг-екв/л — середньої твердості, понад 7 мг-екв/л — твердою і понад 14 мг-екв/л — дуже твердою.
Зі збільшенням твердості води погіршується розварювання м'яса і бобових, збільшується витрата мила, оскільки піна після намилювання утворюється лише тоді, як уся кількість кальцію та магнію води буде зв'язана жирними кислотами мила. Після миття голови через осідання кальцієвих і магнієвих солей жирних кислот волосся стає жорстким. Збільшується утворення накипу в парових котлах і радіаторах, що призводить до надлишкових витрат палива, потреби частого очищення котлів і радіаторів, а інколи до вибухів парових котлів.
Через різкий перехід від використання м'якої до твердої, а особливо сульфатної, води, що буває в туристичних або експедиційних умовах, а також унаслідок зміни місця проживання можуть виникнути тимчасові диспепсичні явища. Гіпотеза про роль твердої води в етіології і патогенезі нирковокам'яної хвороби дотепер не знайшла підтвердження, хоча експериментальні і статистичні дослідження деяких авторів свідчать про те, що вживання твердої води, особливо в умовах спекотного клімату, може спричинити появу ниркових каменів або прискорити збільшення їхніх розмірів.
Останніми роками численні епідеміологічні дослідження, виконані в Англії, США, Японії та інших країнах, виявили, що існує зворотна залежність між рівнем твердості води і смертністю від серцево-судинних захворювань. У деяких місцях позитивні зміни спостерігались уже через кілька років після того, як твердість води підвищили штучним шляхом, а штучне пом'якшення води в інших районах вплинуло на здоров'я населення негативно. В одному з регіонів штату Флорида постачання дощовою водою замінили постачанням водою з глибоких криниць і за 4 роки смертність від серцево-судинних захворювань знизилась удвічі. Механізму захисної дії твердої води дотепер не з'ясовано. Невідомо, пояснюється він наявністю кальцію, магнію або яких-небудь супровідних мікроелементів (наприклад, фтору), чи навпаки, їхньою відсутністю у твердих водах. Поки що більшість дослідників схильні приписувати захисну роль, головним чином, кальцію, який разом із магнієм є компонентом ферментативної системи міокарда і регулює тут баланс електролітів. Зниження рівня кальцію в крові людини (і зміна співвідношення Ca/Mg) тягне за собою продовження інтервалу Q—T на ЕКГ, схильність до аритмії і ризик раптової смерті. Між іншим, у сироватці крові населення, що споживає м'яку воду, рівень кальцію знижений. Є свідчення того, що в країнах, розміщених на скальних, докембрійських гірських породах, підземні води м'які, а захворюваність на серцево-судинні захворювання вища, ніж у місцевостях із вапняковими породами, які збагачують підземні води кальцієм і мікроелементами. На думку авторів, значення води як джерела кальцію для організму людини більше, ніж вважали колись. Річ у тім, що кальцій багатьох харчових продуктів засвоюється лише на 30%, тоді як кальцій питної води — на 90%. Слід зауважити: овочі, зварені в м'якій воді, втрачають значну кількість кальцію, а приготовані у твердій воді навіть збагачуються кальцієм за рахунок осідання його на поверхні овочів. Таким чином, нормування твердості, а також концентрації кальцію та магнію у воді тепер ускладнилося.
Згідно з МСПВ-73, рекомендується загальна твердість води приблизно 2 мг-екв/л (100 мг/л СаС03), а МПР —10 мг-екв/л; вміст кальцію відповідно — 75 і 200 мг/л. Однак є підстави вважати, що з точки зору сучасних знань оптимальна твердість води має становити 5—7 мг-екв/л, а вміст кальцію —150 мг/л. Магній за наявності сульфатів (MgS04— англійська сіль) може надавати воді своєрідного присмаку, а також спричинювати подразнення кишок і посилення перистальтики. Тому, якщо у воді міститься до 250 мг/л сульфатів, допускається концентрація магнію до 150 мг/л, коли ж сульфатів більше, тоді бажано, щоб магнію було не більше ніж 30 мг/л (МСПВ-73).
Залізо. Залізо міститься у підземних водах, головним чином, у вигляді бікарбонату закису заліза — Fe(HC03)2. Унаслідок контакту води з повітрям бікарбонатне залізо окислюється з утворенням бурих пластівців гідрату оксиду заліза — Fe(OH)3, який надає воді мутності і кольору. Гуміновокисле залізо, яке міститься в поверхневих водах, є стійкішим.
Якщо вміст заліза у воді підземних джерел перевищує 0,3—0,5 мг/л, зовнішній вигляд води може погіршуватися (опалесценція, мутність), а вміст заліза понад 2 мг/л надає воді, окрім мутності і кольору, неприємного в'яжучого присмаку. Крім цього, високий вміст заліза у воді псує смак чаю, під час прання білизни надає їй жовтуватого відтінку і лишає іржаві плями, призводить до посиленого розмноження залізистих мікроорганізмів у водогінних трубах, що зменшує їхній просвіт, а в разі відділення відкладень зі стінок труб погіршує зовнішній вигляд і смак водогінної води. Бажано, щоб уміст загального заліза у водогінній воді не перевищував 0,1 мг/л, а максимально припустима концентрація була 1 мг/л (МСПВ-73).
Хлориди (хлор-іон). Зазвичай у проточних водоймах уміст хлоридів незначний (до 20—30 мг/л) і може значно збільшуватись у водоймах, які не мають відтоків. Незабруднені криничні води у місцевостях із несолончаковим грунтом зазвичай містять до 30—50 мг/л хлоридів. Вода, що фільтрується через солончаковий ґрунт або осадові породи, багаті на хлористі сполуки, може містити сотні і навіть тисячі міліграмів хлоридів у 1 л, будучи бездоганною щодо інших показників.
Вода, в якій є хлор-іону понад 350—500 мг/л, має солонуватий присмак і несприятливо впливає на шлункову секрецію. Тому рекомендується, щоб вміст хлоридів у водогінній воді не перевищував 200 мг/л, а МПР — 600 мг/л.
Сульфати (сульфат-іон). Сульфати в кількостях понад 400—500 мг/л надають воді гіркувато-солоного присмаку, несприятливо впливають на шлункову секрецію і можуть спричиняти диспепсичні явища (особливо при одночасному великому вмісті магнію у воді) в осіб, які не звикли до води такого складу. Рекомендований рівень сульфатів —200, а максимально припусти¬мий — 400 мг/л.
У багатьох аридних місцевостях досить часто доводиться використовувати для питного водопостачання солонувату або гірко-солону воду, що містить до 2000—4000 мг/л солей, в яких концентрації сульфатів, хлоридів, кальцію і магнію перевищують гігієнічні норми. Органи охорони здоров'я цих країн дійшли висновку: корінні мешканці більшості подібних місцевостей без помітної шкоди здоров'ю використовують для пиття високомінералізовані води і так звикають до їхніх органолептичних властивостей, що привозна прісна вода здається їм несмачною. Однак потрібно визнати, що ґрунтовних досліджень, які підтверджували б нешкідливість багаторічного вживання різними контингентами населення високомінералізованих вод із різним складом солей, немає.
Що ж до осіб, які приїздять у такі аридні місцевості, то вони обов'язково хворіють на диспепсію. У хворих на хронічну дизентерію та інші кишкові захворювання спостерігаються загострення. Шляхом поступової адаптації до вживання місцевих високомінералізованих вод можна у декілька разів знизити частоту виникнення цих порушень. Приїжджим спочатку рекомендують вживати місцеву воду, розведену прісною (або дистильованою) до концентрації солей 800—1000 мг/л. З кожним наступним днем підвищують концентрацію солей у воді на 200—300 мг/л. Є дані, що протягом 10—12 днів приїджа людина може адаптуватися до води, яка містить до 2500—3000, а інколи і 4000 мг/л солей.
Нітрати (нітрат-іон). Високі концентрації нітратів бувають переважно у воді криниць, які живляться ґрунтовими водами, забрудненими компонентами азотних добрив і продуктами розкладу органічних речовин. Аби запобігти захворюванням на водонітратну метгемоглобінемію, вміст нітратів у воді не повинен перевищувати 45 мг/л, з розрахунку на азот нітратів —11 мг/л.
Фториди (фтор-іон). Фтористі сполуки вимиваються водою з ґрунту і гірських порід. Вміст фтору в природних водах здебільш коливається від сотих частин міліграма до 20 мг/л. Вода відкритих водойм і неглибоких криниць часто містить мало (менше ніж 0,5 мг/л) фтору. Високі концентрації фтору найчастіше зустрічаються у глибоких підземних водах, які омивають поклади фосфоритних або апатичних конкрецій, а також у поверхневих водоймах, які живляться багатими на фтор підземними водами.
Певна кількість фтору потрібна організмові для оптимального розвитку і доброї мінералізації кісток і зубів. Проведені у багатьох країнах дослідження довели, що за інших умов захворюваність на карієс зубів закономірно знижується з підвищенням концентрації фтору у воді. При вживанні води, яка містить 1 — 1,5 мг/л фтору, захворюваність на карієс зубів мінімальна. Очевидно, через це знижується і захворюваність на серцево-судинні хвороби. Однак у разі збільшення концентрації фтору у воді її вживання несприятливо впливає на організм, спричинюючи флюороз. Такі місця на земній кулі називаються осередками ендемічного флюорозу. Унаслідок дії надлишку фтору насамперед ушкоджуються зуби. Резорбований у травному каналі фтор діє на чутливі до нього зародки зубів (амелобласти) і порушує формування та мінералізацію емалі. Зовнішнім проявом цього є утворення так званої плямистої емалі, яка виявляється на постійних, що прорізуються, і рідше на молочних зубах. У разі концентрації фтор-іону у воді до 1,5 — 2 мг/л ураження характеризується крейдо- і фарфороподібними, інколи слабко пігментованими в жовтий колір плямами на симетрично розміщених зубах (1-й і 2-й ступінь ураження).
За значних концентрацій фтор-іона у воді на зубах з'являються ураження 3-го і 4-го ступеня, які характеризуються пігментованим в коричневий колір плямами і дефектами емалі — ерозіями. Такі зубрі спотворюють прикус, характеризуються крихкістю і передчасно стираються.
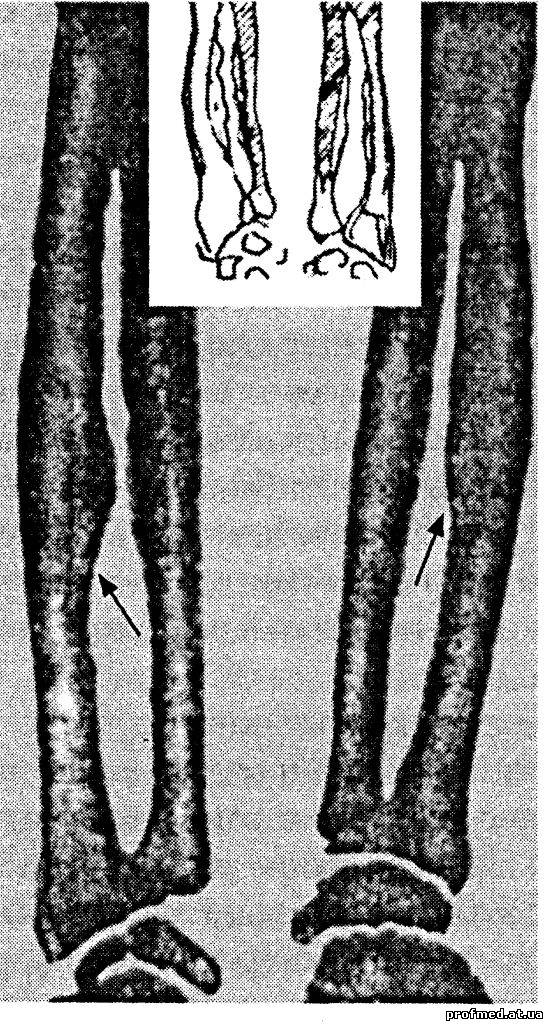 Ураження зубів є лише одним із симптомів флюорозу. Описано місцевості, в яких населення користувалося джерелами, що містять 5 — 18 мг/л фтору. У людей, котрі вживали таку воду протягом 10 — 30 років, крім ураження зубів, спостерігалися випадки генералізованого остеосклерозу з кальцифікацією міжхреоцевих зв'язок, що спричинює обмеження рухомості хребта і деякі порушення кісток, нервової системи і внутрішніх органів (мал. 29).
Ураження зубів є лише одним із симптомів флюорозу. Описано місцевості, в яких населення користувалося джерелами, що містять 5 — 18 мг/л фтору. У людей, котрі вживали таку воду протягом 10 — 30 років, крім ураження зубів, спостерігалися випадки генералізованого остеосклерозу з кальцифікацією міжхреоцевих зв'язок, що спричинює обмеження рухомості хребта і деякі порушення кісток, нервової системи і внутрішніх органів (мал. 29).Оскільки водопостачання залежить від кліматичних умов, МСПВ-73 рекомендує оптимальний вміст фтору залежно від місцевої середньорічної максимальної денної температури повітря. Якщо вона в межах 10—12 °С, то рекомендується вміст фтору 0,9 мг/л, 12,1 — 17,6 °С - 0,8 мг/л, 17,7-26,2 °С - 0,7 мг/л, 26,3-32,6 °С - 0,6 мг/л. МПР фтору - відповідно 1,7; 1,5-1,3; 1,2-1,0; 0,8 мг/л.
Є деякі хімічні сполуки, які можуть впливати на органолептичні властивості води в концентрації значно меншій, ніж токсичні. До них належать мідь, яка надає воді терпкого присмаку і блакитного забарвлення (МСПВ-73 рекомендує рівень до 0,05, МПР — 1,5 мг/л), цинк, який надає воді терпкого присмаку й опалесценції (рекомендований рівень — до 5, МПР —15 мг/л), марганець, що змінює забарвлення, створює помутніння (відповідно 0,05 і 0,5 мг/л), фенольні сполуки, що надають аптечного присмаку і запаху воді, особливо після хлорування внаслідок утворення хлорфенолів (до 0,001, МПР — 0,002 мг/л), аніонні детергенти, які надають воді специфічного присмаку, утворюють піну, негативно впливаючи на знезараження води (до 0,2, МПР — 1 мг/л), мінеральні масла, які надають воді своєрідного запаху після хлорування (до 0,01, МПР — 0,3 мг/л).
Показники нешкідливості містять регламенти для таких токсичних речовин: арсен — 0,05 мг/л, кадмій — 0,01, ціаніди в перерахунку на CN — 0,05, свинець — 0,1, ртуть — 0,001, селен — 0,05 тощо. Концентрації шести канцерогенних речовин із групи ПАВ (флюорантен; 3,4-бензфлюорантен; 11,12- бензфлюорантен; 3,4-бензпірен; 1,12-бензперилен; індиго (1, 2, З-сd/пірен) не повинні перевищувати 0,2 мг/л. Радіоактивність питної води визначають за наявності показників, які дають змогу передбачити підвищену природну активність води або її антропогенне забруднення радіонуклідами.
Зазвичай найменш активними є атмосферні води (п * 10-12— п * 10-14 Кі/л), які вимивають із повітря радіоактивні аерозолі. Збільшена активність атмосферних опадів (за рахунок калію-40, урану-238 та ін.) спостерігається в районах вулканічної діяльності та у великих індустріальних центрах унаслідок забруднення повітря димовими частинками.
Інтенсивніше радіоактивне забруднення атмосферних опадів може спостерігатися в місцях розміщення атомних електростанцій та інших підприємств, які використовують радіонукліди, у разі ненадійного функціонування санітарно-технічного обладнання для дезактивації викидів у атмосферу або аварійних ситуацій.
Природна радіоактивність підземних вод залежить від кількості розчинних радіонуклідів, які містяться в ґрунті і гірських породах, що їх вони омивають. Радіоактивність, головним чином, зумовлена наявністю калію-40, радію-226, радону-222, природного урану тощо. Найменшу активність мають підземні води, що залягають в осадових породах і найчастіше використовуються для водопостачання населення. Найчастіше їхня активність зростає зі збільшенням мінералізації. Питома їхня активність за природним ураном — 10-50 мкг/л, радієм-226 — 2 * 10-12 Кі/л, радоном-222 — 5 * 10-10 Кі/л. Води, що залягають у корінних породах (наприклад, у тріщинуватих гранітах), мають більшу активність. Часто значну активність мають лікувальні мінеральні води (активність за радієм і радоном до п * 10-9 Кі/л). Висока активність підземних вод, розміщених близько до місця залягання радіоактивних руд, а також міжпластових вод у районах нафтових родовищ. Вибивання їх на поверхню під час буріння призводить до збільшення радіоактивності ґрунтового покриву і водойм, куди стікають ці води. Антропогенне забруднення підземних вод спостерігається в разі забруднення ґрунту радіоактивними опадами або твердими чи рідкими відходами об'єктів, які використовують радіоактивні продукти, а також у місцях неправильного захоронення відходів (у водопроникних могильниках).
Ступінь загальної радіоактивності річкових вод зумовлена типом їхнього живлення, але здебільшого вона незначна, порядку п * 10-12 Кі/л. Рідше у річках, але частіше у безвідтічних озерах питома активність порядку п * 10-11 Кі/л, в океанах —2,4—3,2* 10-10 Кі/л. Вода відкритих водойм може забруднюватися внаслідок випускання в них неочищених радіоактивних стічних вод.
Потрапляючи у воду відкритих водойм, радіонукліди розводяться, пересуваються з течіями, а також поглинаються дном, де нагромаджуються в мулі і гідробіонтах. Накопичені на дні радіонукліди можуть надходити у воду, а також мігрувати по біологічному ланцюжку. Концентрація радіонуклідів у гідробіонтах може бути в 102—104 разів більшою, ніж у воді.
Міжнародний стандарт наводить такі безпечні рівні радіоактивності питної води: сумарна а-активність —3, а b- активність —30 nKi/л. Ці рівні активності допускаються, якщо вони є середніми в межах тримісячного періоду. Якщо активність перевищує ці рівні, то для вирішення питання щодо придатності води для пиття потрібно виконати радіохімічний аналіз з метою визначення вмісту у воді окремих радіонуклідів. Наведемо припустимі концентрації окремих радіонуклідів у питній воді, згідно з нормами радіаційної безпеки (в Кюрі на літр): радій-226 — 5,4 * 10-11, уран природний — 1,2 * 10-9 (1,8 мг/л), уран-238 - 5,9 * 10-10 (1,8 мг/л), торій природний — 3,3 * 10-11 (0,15 мг/л), стронцій-90 - 4 * 10-10, цезій-137 - 1,5 * 10-8, йод-131 - 1 * 10-9, полоній-210 - 3,9 * 10-10, свинець-270 - 7,7 * 10-11, вуглець-14 - 8,2 * 10-7, тритій - 3,2 -10-8.
Для води з джерел водопостачання, крім показників, що нормуються стандартом, визначають хімічні показники можливого забруднення, які мають епідеміологічне значення. До них відносяться органічні речовини і продукти їхнього розпаду: амонійні солі, нітрити і нітрати. Крім нітратів, перераховані сполуки в тих кількостях, в яких вони зазвичай зустрічаються в природних водах, не впливають на здоров'я людини. Вони можуть лише сигналізувати про забруднення ґрунту, через який протікає вода, і про те, що разом із цими речовинами у воду могли потрапити патогенні мікроорганізми.
В окремих випадках кожний хімічний показник може мати іншу природу, наприклад, органічні речовини — рослинне походження. Очевидно, визнати водне джерело забрудненим можливо лише за таких умов:
1) у воді є не один, а кілька хімічних показників забруднення;
2) у воді одночасно виявлено бактеріальні показники забруднення — наприклад, кишкову паличку;
3) можливість забруднення підтверджується санітарним обстеженням водного джерела.
Показником наявності органічних речовин у воді є окислення. Воно виражається в міліграмах кисню, що витрачається на окислення органічних речовин, які містяться віл води. Найменше окислення мають артезіанські води — до 2 мг 02 на 1 л, у водах шахтних колодязів окислення досягає 3,4 мг 02 на 1 л. Зі збільшенням інтенсивності кольору води окислення зростає. У воді відкритих водойм окислення може бути вищим.
Підвищення окислення води понад названі величини свідчить про можливе забруднення джерела води.
Головним джерелом появи амонійного азоту і нітритів у природних водах є розкладання білкових залишків, трупів тварин, сечі, фекалій.
Зі свіжим забрудненням, викидами у воді зростає вміст амонійних солей (перевищує 0,1 мг/л). Як продукт подальшого хімічного окислення амонійних солей нітрити в кількості, яка перевищує 0,002 мг/л, також служать важливим показником забруднення джерела води. Потрібно враховувати, що в глибоких підземних водах можливе утворення нітритів та амонійних солей із нітратів під час процесів відновлення. Нітрати є кінцевим продуктом окислення амонійних солей. Наявність їх у воді за відсутності аміаку і нітритів свідчить про порівняно давнє надходження у воду азотовмісних речовин, які встигли вже мінералізуватися. Інтенсивне використання азотовмісних добрив також призводить до збільшення рівня нітратів у ґрунтових водах.
Одним із показників забруднення водного джерела є хлориди, оскільки вони є в сечі і різних викидах. Але слід ураховувати, що велика кількість хлоридів у воді (понад 30—50 мг/л) може бути зумовлена і вимиванням хлористих солей із засолених ґрунтів.
Для правильної оцінки походження хлоридів слід ураховувати характер водного джерела, наявність хлоридів у воді сусідніх однотипних водних джерел, а також інші показники забруднення води.
Гігієнічні вимоги до якості води централізованого господарського водопостачання, порядок здійснення державного санітарно-епідеміологічного нагляду за якістю води у системах централізованого господарсько-питного водопостачання у звичайних та екстремальних ситуаціях, а також відповідальність за недотримання цих вимог викладено в Державних санітарних правилах і нормах (ДСанПіН) "Вода питна. Гігієнічні вимоги до якості води централізованого господарсько-питного водопостачання", які затверджено наказом МОЗ України 23 грудня 1996 р. за № 383.
